Diskdiffusionsmetod
På ytan av ett tätt näringsmedium, ympat med en kontinuerlig gräsmatta med testkulturen, appliceras inte mer än 6 skivor som är blötlagda i antibiotika, på ett avstånd av minst 2 cm från varandra. Registrering av resultat utförs efter 18-24 timmars inkubation i en termostat längs zonens diameter utan tillväxt runt skivorna med antibiotika. Närvaron av tillväxt runt skivan indikerar att mikroben är okänslig för antibiotikumet. Speciella tabeller används för att tolka resultaten.
Figur 1. Bestämning av känslighet
mikroorganismer med diskdiffusionsmetoden:
1 - mikroorganism känslig antibiotikum;
2 - mikroorganism måttligt resistent antibiotikum;
3 - mikroorganism stadig till ett antibiotikum.
E-testmetod
Metodens princip. Bestämning av känsligheten hos en mikroorganism utförs på samma sätt som testning med diskdiffusionsmetoden. Skillnaden är att istället för en skiva med ett antibiotikum används en E-testremsa som innehåller en gradient av antibiotikakoncentrationer från max till minimum. Vid skärningspunkten mellan den elliptiska tillväxtinhiberingszonen och E-testremsan erhålls minsta hämmande koncentration (MIC).

Figur 2. Bestämning av känsligheten hos mikroorganismer med hjälp av E-test
Seriell utspädningsmetod i buljongmedium
I provrör som innehåller 1 ml Muller -Hinton -buljong bereds tvåfaldiga utspädningar av det antibakteriella läkemedlet, till exempel 100 μg / ml - 1: a, 50 μg / ml - 2: a, 25 μg / ml - 3: e, 12,5 μg / ml - 4: e osv. Därefter tillsätts 0,1 ml av den testade bakteriesuspensionen till varje rör. Samtidigt ställs tillväxtkontrollen in (1 ml Mueller-Hinton-buljong och 0,1 ml bakteriesuspension). Grödor inkuberas vid 37 ° C i 18-24 timmar, varefter resultaten noteras. Frånvaron av grumlighet av mediet indikerar en fördröjning av bakterietillväxten i närvaro av en given koncentration av läkemedlet.

Figur 3. Bestämning av MIC -värdet genom utspädning i ett flytande näringsmedium
Minsta hämmande koncentration (MIC) är den lägsta koncentrationen av ett antibiotikum (i μg / ml eller mg / L) som helt undertrycker synlig bakterietillväxt in vitro.
2 Bestämning av känsligheten hos olika stammar av stafylokocker för antibiotika genom metoden för standardskivor
|
Antibiotikum |
Tillväxtundertryckningszon, mm |
Egenskaper hos stammen |
Den studerade kulturen är känslig för __________________________________________________
måttligt resistent mot _________________________________________________________________________,
motståndskraftig mot _________________________________________________________________________________.
3 Bestämning av den minsta hämmande koncentrationen (MIC) av penicillin genom serieutspädningar.
Produktion: MIC för penicillin för den undersökta stammen är _____________________________________
Fördelar med metoden: ____________________________________________________________________________
Nackdelar med metoden: ____________________________________________________________________________
4 Identifiering och registrering av olika typer av bakteriers antagonistiska verkan.
En mikrobe-antagonist och teststammar ympas vinkelrätt mot den på en tallrik med MPA med ett slag längs diametern. Resultaten registreras en dag efter sådd. Närvaron och graden av antagonistisk verkan bestäms av storleken på zonerna för tillväxtinhibering av testkulturer.
Stroke sådd ________________________
Produktion: den största antagonistiska effekten avslöjades för teststammar (ange arter) _____________________________________________________________________________________________
LEKTION nummer 8
TEMA: SAMMANFATTNINGSLESSON OM ÄMNET: "HISTORISKA STEG I MIKROBIOLOGIENS UTVECKLING, MORFOLOGI, FYSIOLOGI OCH GENETIK."
Former och storlekar på riktiga bakterier. Egenskaper hos sfäriska, stavformade och invecklade former av riktiga bakterier.
Bakteriernas struktur. De viktigaste skillnaderna mellan prokaryota celler och eukaryoter.
Cellvägg av grampositiva och gramnegativa bakterier.
Typer av mikroskopiska preparat. Teknik för att förbereda fasta preparat.
Mikroskopiteknik i ett ljusmikroskop. Studie av mikroorganismernas morfologi i ett elektronmikroskop.
Tinktoriska egenskaper hos mikrober. Färgämnen. Enkla sätt att färga fasta preparat.
Klassificeringsprinciper för patogena prokaryoter (Burgey, 2001).
Skyddsanordningar för mikroorganismer. Tvister, stadier och villkor för bildandet av tvister, biologisk betydelse.
Bakteriekapslar, deras betydelse.
Flagella, deras struktur. Cilia. Vi drack sex.
Svåra målningsmetoder. Målningsteknik enligt Gram, Tsilu-Nelsen, Burri-Gins, Neisser.
Metoder för att studera mikroorganismer i ett levande tillstånd. KOH -test. Metodens princip.
Spirochetes. Systematisk position och morfologi hos spiroketer. Funktioner av ultrastruktur och kemisk sammansättning. Forskningsmetoder.
Actinomycetes, morfologi, ultrastruktur, kemisk sammansättning. Patogena arter. Aktinomyceternas roll i naturen och medicinen. Detekteringsmetoder.
Taxonomi för klamydia. Morfologi, struktur, metoder för identifiering. Chlamydia utvecklingscykel.
Rickettsiae, morfologi, ultrastruktur, kemisk sammansättning. Patogena arter.
Mykoplasma. Klassificering. Fylogenes. Detekteringsmetoder.
Defekta former av mikrober: protoplaster, sfäroplaster, L-former.
Näring av bakterier. Näringsämnen är källor till kol och kväve. Klassificering av bakterier efter näringstyper Autotrofer och kemoorganotrofer
Tillväxtfaktorer och deras källor. Källor till mineraliska element.
Metoder och mekanismer för överföring av näringsämnen över membranet.
Energibehovet hos bakterier. Sätt att få energi i autotrofer (fotosyntes, kemosyntes). Källor och sätt att få energi i kemoorganotrofer.
Aeroba och anaeroba typer av biologisk oxidation hos bakterier. Aeroba, anaeroba, fakultativt anaeroba och mikroaerofila bakterier. Metoder för att skapa anaeroba förhållanden.
Uppgifter, stadier, fördelar och nackdelar med den bakteriologiska (kulturella) forskningsmetoden.
Tillväxt och reproduktion av mikroorganismer. Reproduktionsmetoder. Binär (enkel) uppdelning, mekanism. Reproduktion av bakteriepopulationer.
Principer och metoder för bakteriell odling. Näringsbehov hos mikrober.
Kulturmedier för odling av bakterier. Krav på kulturmedia. Klassificering av kulturmedier.
Villkor och tekniker för odling av bakterier. Såteknik på näringsmedier. Regelbundenhet och typ av bakterietillväxt på fasta och flytande näringsmedier.
Metoder för att isolera rena kulturer av aeroba och anaeroba bakterier.
Egenskaper hos mikroorganismer som används för att identifiera isolerade kulturer.
Bakteriella enzymer, klassificering. Metoder för att studera biokemiska egenskaper hos mikroorganismer. Praktisk användning av biokemisk aktivitet vid identifiering av bakterier
Bestämning av sackarolytiska egenskaper, sammansättning av Giss -media; bestämning av proteolytiska egenskaper, bestämning av katalas och oxidasaktivitet.
Funktionsprincipen och egenskaperna vid användning av enheter för automatisk identifiering av bakteriekulturer (blododlare, automatisk analysator).
Funktioner för odling av rickettsia och chlamydia.
Bakteriofager (fag). Upptäcktshistoria. Morfologi, strukturella särdrag, kemisk sammansättning och egenskaper hos fag.
Virulenta fager. Interaktionsfaser med en bakteriecell. Resultaten av växelverkan mellan fag och cell. Måttliga fager. Profet. Fenomenet lysogeni. Fagomvandling.
Metoder för isolering och titrering av bakteriofager på fasta och flytande näringsmedier Tillämpning av fager inom mikrobiologi och medicin. Fagodiagnostik och fagskrivning.
Ärftlighet. Organisationen av den genetiska apparaten i bakterier (nukleoid, plasmider, Är-följder, transposoner).
Principerna för det bakteriella genomets funktion. Operonens organisation. Genotyp och fenotyp.
Plasmider, klassificering, struktur och egenskaper hos plasmider. R-plasmid, egenskaper hos struktur och funktion. Bakteriocinogenesplasmider.
Mikrobiell variation. Modifieringar av bakterier, betydelse, huvudmanifestationer och egenskaper (icke-ärftlig natur, anpassningsförmåga, hög frekvens av direkta och omvända förändringar, många inducerande faktorer).
Genotypisk variation. Mutationer och deras klassificering. Mutagener. Fenotypiska manifestationer av mutationer. Mutanternas öde. Dissociation i bakterier. Urvalets inflytande. Genomskadningsreparationssystem.
Rekombinationsvariabilitet. Mekanismer för bildandet av kombinerade genomer. Frekvensen av förändringar i enskilda tecken. Transformation, transduktion, konjugering.
Det praktiska värdet av kunskap om mikrobernas genetik. Principer för genetisk kartläggning.
Genetiska analysmetoder (molekylär hybridisering, polymeraskedjereaktion, blotting, sekvensering).
Begreppet genteknik och användningen av dess metoder inom mikrobiologi och bioteknik. Erhållande och tillämpning av genetiskt manipulerade vacciner och cytokiner.
Antimikrobiella åtgärder. Påverkan av miljöfaktorer på mikrober. Verkan av fysiska faktorer (temperatur, torkning, strålning, ultraljud, osmotiskt tryck). Kemiska faktorers verkan.
Syften, metoder, medel och syften med sterilisering och desinfektion i medicinsk och mikrobiologisk praxis. Kvalitetskontroll av desinfektion. Sterilisering och sterilitetskontroll. Sätt att genomföra.
Antiseptisk. Definition. Antiseptika, krav, ursprung, egenskaper, grupper, verkningsmekanismer på mikrober. Typer av antiseptika. Terapeutiskt antiseptiskt. Förebyggande antiseptisk.
Kemoterapimedicin. Egenskaper. De viktigaste grupperna av kemoterapimedicin. Verkningsmekanismer på bakterier. Begreppet selektivitet och "mål" för handling.
Antibiotika Definition. Antibiotikaproducenter. Syntetiska och halvsyntetiska antibiotika.
De viktigaste grupperna av antibiotika efter kemisk struktur. Betalaktam antibiotika Tetracykliner. Aminoglykosider. Makrolider och azolider. Anzamyciner (rifampiciner). Levomycetin. Fluorokinolonantibiotika. Lincomycin. Polymyxiner. Glykopeptider
Klassificering av antibiotika om verkningsmekanismen på en bakteriecell.
Mekanismer för resistens hos mikroorganismer mot antibakteriella läkemedel.
Metoder för att bestämma bakteriers känslighet för antibiotika och andra kemoterapimedicin. Teknik för inställning, inspelning och bedömning av känslighet med hjälp av skivmetoden, E-test, serieutspädningar.
LEKTION Nr.9
TEMA: BAKTERIENS EKOLOGI. INFEKTION. PATHOGENISKA MIKROORGANISMER. MIKROBIALA TOXINER. BIOLOGISK (EXPERIMENTELL) METOD.
CHECKLISTA
Människokroppens mikroflora . Normal (bosatt) mänsklig mikroflora. Autokton och allokton, parietal och luminal mikroflora. Bildande och utveckling av normal mikroflora. Normal mikrofloras funktioner: anti-infektiös, metabolisk, immunobiologisk, antitoxisk.
Dysmikrobiocenos (dysbakterier), orsaker, typer, principer för korrigering.
Begreppet infektion. Definition, allmänna egenskaper. Skillnader mellan infektionssjukdomar och icke-infektionssjukdomar.
Mikroorganismens roll i den infektiösa processen. Smittsam dos. Infektionsmetoder. Ingångsport. Patogenicitet och virulens. Genetisk kontroll av patogenicitet och virulens. Faktorer som ökar och minskar mikrobernas virulens.
Patogena faktorer. Metoder för att bestämma virulens, enheter. Obligatoriska patogena och opportunistiska mikroorganismer.
Toxicitet och toxicitet för mikroorganismer. Endotoxiner, egenskaper, produktion, applikation. Exotoxiner, egenskaper, produktion, måttenheter. Typer av exotoxiner, verkningsmekanism.
Makroorganismens roll i utvecklingen och förloppet av infektionssjukdomar. Ärftliga faktorer. Kroppens anatomiska och fysiologiska tillstånd. Livsvillkorenas roll i utvecklingen och förloppet av infektionssjukdomar. Naturliga faktorer. Sociala faktorer.
Klassificering av infektionsprocesser efter svårighetsgrad, patogenens art, infektionskälla, patogenens överföringssätt och infektionsmekanism, beroende på prevalens. Klassificering av infektionsprocesser enligt lokaliseringen av det mikrobiella fokuset, kurens varaktighet och infektionsfrekvensen.
Dynamik i den infektiösa processen, dess funktioner.
Biologisk (experimentell) forskningsmetod, stadier, bedömning. Försöksdjur. Infektionsmetoder.
LABORATORIARBETE
1 Studie av normal mikroflora.
A) Ympning för studier av normal mikroflora i händerna på Endo -medium och blodagar replikmetod.
Metodprincip: fukta sterila bitar av filterpapper 1x1 cm i en petriskål med sterilt nat. lösning. Använd en steril pincett, lägg ett papper på den undersökta ytan av händerna i 0,5 minuter. Placera papperet på ytan av ett tätt tillväxtmedium (tryck) i 1 min. Ta bort papperet. Inkubera tallrikar med tryck vid 37 0 С, 24-48 timmar.
C) Gör en inventering av mikroflorainokulation, förbered preparat från olika typer av kolonier, fläck enligt Gram, mikroskopi (i demonstrationsgrödor).
Redovisning för sådd av mikroflora:
Mikroskopi av preparat:
|
En drog______________ _______________________ Färgsättning _______________ _______________________ |
En drog______________ _______________________ Färgsättning _______________ _______________________ |
2 Bedömning av vidhäftningE. coligenom deras förmåga att adsorbera på ytan av erytrocyter
Metodprincip: Testkulturen för mikroorganismer tillsätts till erytrocyt -suspensionen. Efter inkubation förbereds, färgas utstryk och det genomsnittliga antalet bakterier som adsorberas på en erytrocyt bestäms under ett mikroskop.
Erytrocyter används i detta fall som modell för en cell hos en mottaglig mikroorganism.
3 Bestämning av invasiva enzymer i stafylokocker
1. Plasmakoagulas
Metodens princip: Testkulturen införs i ett provrör som innehåller citrerat kaninblodplasma. Efter inkubation i en termostat beaktas resultatet. Om resultatet är positivt, koagulerar plasma (koagulerar).
2.Fibrinolysin
Metodens princip: Testkulturen införs i ett provrör med fibrin (en blodpropp tvättad från erytrocyter). Efter inkubation i en termostat beaktas resultatet. Om resultatet är positivt löses blodproppen upp.
3.Hyaluronidas
Metodens princip: Testkulturen införs i ett provrör med hyaluronsyra (HAA). Efter inkubation i en termostat, tillsätt ett reagens som får HAA att koagulera och ta hänsyn till resultatet. Om resultatet är positivt (på grund av HUA -klyvning) bildas ingen koagel.
4.Lecitovitellas (lecitinas)
Metodens princip: isolerade kulturer av stafylokocker ympas på äggula-saltagar, som innehåller 7,5% natriumklorid och äggulasuspension. Med ett positivt resultat bildas en iriserande halo runt kolonierna av virulenta stafylokocker på grund av nedbrytning av lecitin i äggulans äggula.
Slutsats: (lista virulensenzymerna för var och en av de två studerade stammarna) _____________________________________________________________________________________________
_____________________________________________________________________________________________
Bakteriella toxiner
Toxicitet __________________________________________________________________________________
Toxicitet _________________________________________________________________________________
Endotoxin ___________________________________________________________________________________
Endotoxisk chock ___________________________________________________________________________
Praktisk tillämpning av endotoxiner:
Exotoxin ___________________________________________________________________________________
Toxoid ____________________________________________________________________________________
Schema för att erhålla exotoxin och toxoid.
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
4.____________________________________________________________________________________________
Praktisk tillämpning av toxoider:
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
3.____________________________________________________________________________________________
Föreläsningen diskuterar de viktigaste metoderna för att bestämma känsligheten in vitro mikroorganismer till antimikrobiella läkemedel (skivdiffusion, E-test, utspädningsmetoder). Tillvägagångssätt för empirisk och etiotropisk förskrivning av antibiotika i klinisk praxis återspeglas. Frågorna om att tolka resultaten av att bestämma känsligheten från de kliniska och mikrobiologiska synpunkterna diskuteras.
För närvarande, i klinisk praxis, finns det två principer för förskrivning av antibakteriella läkemedel: empiriska och etiotropa. Empiriskt recept på antibiotika baserat på kunskap om bakteriers naturliga känslighet, epidemiologiska data om resistens hos mikroorganismer i regionen eller sjukhuset, samt resultaten av kontrollerade kliniska prövningar. Den otvivelaktiga fördelen med empirisk förskrivning av kemoterapiläkemedel är möjligheten till en snabb start av behandlingen. Dessutom eliminerar denna metod kostnaden för ytterligare forskning.
Men med antibiotikabehandlingens ineffektivitet, med nosokomiala infektioner, när det är svårt att anta patogenen och dess känslighet för antibiotika, försöker de utföra etiotropisk terapi. Etiotrop recept på antibiotika innebär inte bara att isolera det orsakande medlet från kliniskt material, utan också bestämma dess känslighet för antibiotika. Det är endast möjligt att erhålla korrekta data med kompetent genomförande av alla kopplingar till bakteriologisk forskning: från att ta kliniskt material, transportera det till ett bakteriologiskt laboratorium, identifiera patogenen för att bestämma dess känslighet för antibiotika och tolka de erhållna resultaten.
Den andra anledningen till behovet av att bestämma mikroorganismernas känslighet för antibakteriella läkemedel är att erhålla epidemiologiska data om resistensstrukturen hos patogener för samhällsförvärvade och nosokomiella infektioner. I praktiken används dessa data för empirisk förskrivning av antibiotika, liksom för bildande av sjukhusjournaler.
Testmetoder för antibiotikakänslighet
Metoder för att bestämma bakteriers känslighet för antibiotika är indelade i 2 grupper: diffusions- och utspädningsmetoder.
Vid bestämning av känsligheten med diskdiffusionsmetoden appliceras en bakteriesuspension med en viss densitet (vanligtvis ekvivalent med en McFarland -turbiditetsstandard på 0,5) på agarytan i en petriskål och placeras sedan skivor som innehåller en viss mängd antibiotika . Spridning av antibiotikumet till agar leder till bildandet av en zon för undertryckande av tillväxten av mikroorganismer runt skivorna. Efter inkubation av plattorna i en termostat vid en temperatur på 35 ° -37 ° C över natten, ta hänsyn till resultatet genom att mäta diametern på zonen runt skivan i millimeter ().
Bild 1. Bestämning av känsligheten hos mikroorganismer genom diskdiffusionsmetoden.
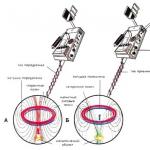
Bestämning av känsligheten hos en mikroorganism med hjälp av E-testet utförs på samma sätt som testning med diskdiffusionsmetoden. Skillnaden är att istället för en skiva med ett antibiotikum används en E-testremsa som innehåller en gradient av antibiotikakoncentrationer från max till minimum (). Vid skärningspunkten mellan den elliptiska tillväxtinhiberingszonen och E-testremsan erhålls minsta hämmande koncentration (MIC).

Figur 2. Bestämning av känsligheten hos mikroorganismer med hjälp av E-test.
Den otvivelaktiga fördelen med diffusionsmetoder är enkelheten i tester och tillgängligheten för implementering i alla bakteriologiska laboratorier. Men med tanke på den höga kostnaden för E-tester används vanligtvis diskdiffusionsmetoden för rutinarbete.
Avelmetoder baserat på användning av dubbla serieutspädningar av antibiotikakoncentrationer från maximalt till minimum (till exempel från 128 μg / ml, 64 μg / ml, etc. till 0,5 μg / ml, 0,25 μg / ml och 0,125 μg / ml) .. . I detta fall införs antibiotikumet i olika koncentrationer i ett flytande näringsmedium (buljong) eller i agar. Därefter placeras en bakteriesuspension med en viss densitet, motsvarande en grumlighetsstandard på 0,5 McFarland, i en antibiotika buljong eller på ytan av en agarplatta. Efter inkubation över natten vid en temperatur av 35 ° -37 ° C registreras de erhållna resultaten. Närvaron av mikroorganismstillväxt i buljongen (buljongturbiditet) eller på agarytan indikerar att denna koncentration av antibiotikumet är otillräcklig för att undertrycka dess livskraft. När koncentrationen av antibiotikumet ökar, försämras tillväxten av mikroorganismen. Den första lägsta koncentrationen av antibiotika (från en serie serieutspädningar), där bakterietillväxt inte upptäcks visuellt, anses vara minsta hämmande koncentration (MIC)... MIC mäts i mg / l eller μg / ml ().

Figur 3. Bestämning av MIC -värdet genom utspädning i ett flytande näringsmedium.
Tolkning av resultaten för att bestämma känsligheten
Baserat på de kvantitativa data som erhållits (diameter för zonen för hämning av tillväxten av antibiotikumet eller MIC -värdet) är mikroorganismer uppdelade i känsliga, måttligt resistenta och resistenta (). För att skilja mellan dessa tre kategorier av känslighet (eller motstånd), den s.k gränskoncentrationer(brytpunkt) för antibiotikumet (eller gränsvärden för diametern för zonen för hämning av mikroorganismens tillväxt).

Figur 4. Tolkning av resultaten för att bestämma bakteriens känslighet i enlighet med värdena för MIC.
Gränskoncentrationer är inte konstanta värden. De kan revideras, beroende på förändringar i känsligheten hos populationen av mikroorganismer. Utvecklingen och översynen av tolkningskriterierna utförs av ledande specialister (kemoterapeuter och mikrobiologer) som är medlemmar i särskilda kommittéer. En av dem är US National Committee for Clinical Laboratory Standards (NCCLS). För närvarande är NCCLS -standarder erkända i världen och används internationellt för att bedöma resultaten av att bestämma bakteriers känslighet i multicenter mikrobiologiska och kliniska studier.
Det finns två metoder för att tolka resultaten av att bestämma känsligheten: mikrobiologisk och klinisk. Mikrobiologisk tolkning bygger på en analys av fördelningen av antibiotikakoncentrationer som undertrycker bakteriernas livskraft. Klinisk tolkning bygger på att utvärdera effektiviteten av antibiotikabehandling.
Känsliga mikroorganismer (mottagliga)
Kliniskt klassificeras bakterier som känsliga (med hänsyn till de erhållna parametrarna in vitro), om vid behandling av infektioner orsakade av dessa mikroorganismer med standarddoser av ett antibiotikum observeras en god terapeutisk effekt.
I avsaknad av tillförlitlig klinisk information är uppdelningen i kategorier av känslighet baserad på gemensam redovisning av erhållna data in vitro och farmakokinetik, dvs. på antibiotikakoncentrationer som kan uppnås på infektionsstället (eller i serum).
Resistenta mikroorganismer
Resistenta (resistenta) bakterier är bakterier när det vid behandling av en infektion orsakad av dessa mikroorganismer inte finns någon effekt av terapi även när man använder maximala doser av antibiotikumet. Sådana mikroorganismer har resistensmekanismer.
Mikroorganismer med mellanliggande resistens
Kliniskt förstås mellanresistens hos bakterier om infektionen orsakad av sådana stammar kan ha olika terapeutiska resultat. Behandlingen kan dock vara framgångsrik om antibiotikumet används överstigande standarddosen, eller om infektionen är lokaliserad på en plats där det antibakteriella läkemedlet ackumuleras i höga koncentrationer.
Ur mikrobiologisk synvinkel inkluderar bakterier med mellanliggande resistens en delpopulation som överensstämmer med värdena för MIC eller zonenas diameter, mellan mottagliga och resistenta mikroorganismer. Ibland kombineras stammar med mellanresistens och resistenta bakterier till en kategori av resistenta mikroorganismer.
Det bör noteras att den kliniska tolkningen av bakteriers känslighet för antibiotika är villkorad, eftersom utfallet av behandlingen inte alltid bara beror på det antibakteriella läkemedlets aktivitet mot patogenen. Kliniker är medvetna om fall där, med resistens av mikroorganismer, enligt studien in vitro fått en god klinisk effekt. Omvänt, med patogenens känslighet, kan terapi vara ineffektiv.
I vissa kliniska situationer, när det finns otillräckliga resultat av ett känslighetstest med konventionella metoder, bestäms den lägsta bakteriedödande koncentrationen.
Minsta bakteriedödande koncentration (MBC)- den lägsta koncentrationen av antibiotika (mg / l eller mcg / ml), som i studien in vitro orsakar att 99,9% av mikroorganismer dör från den initiala nivån inom en viss tidsperiod.
MBC -värdet används vid behandling med antibiotika med bakteriostatisk verkan, eller i avsaknad av effekten av antibiotikabehandling i en särskild kategori av patienter. Särskilda fall för att bestämma MBC kan till exempel vara bakteriell endokardit, osteomyelit eller generaliserade infektioner hos patienter med immundefekttillstånd.
Avslutningsvis vill jag notera att det idag inte finns några metoder som skulle göra det möjligt att med absolut säkerhet förutsäga den kliniska effekten av antibiotika vid behandling av infektionssjukdomar. Uppgifterna om resultaten för att bestämma känsligheten kan dock fungera som en bra riktlinje för läkare vid val och korrigering av antibiotikabehandling.
Bord 1. Kriterier för tolkning av bakteriens känslighet
Etest® är en remsa av inert plast belagd med ett antimikrobiellt medel vid en koncentrationsgradient som sträcker sig från minimum till maximalt, i ett område som motsvarar 15 tvåfaldiga spädningar. Å andra sidan appliceras en skala för motsvarande minsta inhiberande koncentrationer (MIC) på remsan. Med E-test kan du bestämma den lägsta hämmande koncentrationen av ett antimikrobiellt läkemedel (kvantitativ diffusionsmetod).
... Inokulera skålen med organismens kultur.
... Lägg Etest® -remsor (upp till 2 per 90 mm standardfat, eller upp till 6 per 180 mm fat).
... Under odlingen bildas en elliptisk tillväxtinhiberingszon runt remsan, som skär remsan vid den punkt som motsvarar MIC.
... E-test har använts i över 20 år.
... Mer än 100 antimikrobiella läkemedel.
... Remsor för att upptäcka multimedicinresistens.
... Bestämning av känsligheten hos nyckfulla mikroorganismer, streptokocker, anaeroba mikroorganismer, svampar (inklusive mögel), mycobacterium tuberculosis, etc.
... Bekväm frisättningsform: 30 eller 100 stycken, i en blisterförpackning eller skumpatron.
| Katalognummer | |||||
| Enskild paket |
Skumpatron (t ° lagring + 20 ° С / + 4 ° С) |
(förvaring t ° -20 ° С) |
|||
| namn | 30 remsor | 100 remsor | 30 remsor | 100 remsor | 30 remsor |
| Svampdödande | |||||
| E-test Amphotericin | 526318 | 526310 | |||
| E-test Anidulafungin | 532008 | 532000 | |||
| E-test Voriconazole | 532818 | 532810 | |||
| E-test Itrakonazol | 412380 | 525818 | 525810 | ||
| E-test Kaspofungin | 412269 | 532418 | 532410 | ||
| E-test Ketokonazol | 525918 | 525910 | |||
| E-test Micafungin | 535708 | 535700 | |||
| E-test Posaconazole | 532118 | 532110 | |||
| E-test Fluconazol | 412350 | 510818 | 510810 | ||
| E-test Flucytosine | 510918 | 510910 | |||
| Anti-tuberkulos | |||||
| E-test Isoniazid | 527900 | ||||
| E-test Ethambutol | 527700 | ||||
| E-test Etionamid | 527500 | ||||
| Antibakteriell | |||||
| E-test Azitromycin | 412251 | 501618 | |||
| E-test Aztreonam | 412259 | 501718 | 501710 | ||
| E-test Amikacin | 412219 | 501318 | |||
| E-testa Amoxicillin | 412243 | 500918 | |||
| E-test Amoxicillin / klavulansyra (2/1) | 412241 | 501018 | 501010 | ||
| E-test Ampicillin | 412253 | 501518 | |||
| E-test Ampicillin / sulbactam (2/1) | 412251* | 501818 | 501810 | ||
| E-test Bacitracin | 528608 | 528600 | |||
| E-test bensylpenicillin (hög koncentration) | 412263 | 502518 | |||
| E-test bensylpenicillin (låg koncentration) | 412265 | 502618 | |||
| E-test Vancomycin | 412488 | 525518 | |||
| E-test Gatifloxacin | 530218 | 530210 | |||
| E-test Gentamicin (hög koncentration) | 512708 | 512700 | |||
| E-test Gentamicin (låg koncentration) | 412368 | 512518 | |||
| E-test Daptomycin | 412324 | 535018 | 535010 | ||
| E-test Doxycyklin | 412328*** | 509718 | 509710 | ||
| E-test av Doripenem | 412326*** | 535918 | 535910 | ||
| E-test Imipenem | 412374 | 513618 | |||
| E-test Kanamycin | 527818 | 527810 | |||
| E-test Klaritromycin | 508718 | 508710 | |||
| E-test Clindamycin | 412315 | 509518 | |||
| E-testa Colistin | 412317** | 537308 | 537300 | ||
| E-test Levofloxacin | 412393 | 527418 | |||
| E-test Linezolid | 412396 | 531318 | |||
| E-test Meropenem | 412402 | 513818 | |||
| E-test Metronidazol | 412404 | 530018 | |||
| E-testa Mecillinam | 513708 | 513700 | |||
| E-test Minocyklin | 412409*** | 516018 | 516010 | ||
| E-test Moxifloxacin | 412411** | 529018 | 529010 | ||
| E-testa Mupirocin | 412417*** | 413496 | 516300 | ||
| E-test Nalidixinsyra | 516508 | 516500 | |||
| E-test Netilmicin | 517518 | 517510 | |||
| E-test Nitrofurantoin | 412426*** | 530408 | 530400 | ||
| E-test Norfloclacin | 412428** | 519508 | 519500 | ||
| E-testa Oxacillin | 412432 | 520518 | |||
| E-test Ofloxacin | 519618 | 519610 | |||
| E-testa Piperacillin | 521518 | 521510 | |||
| E-test Piperacillin / tazobactam (4mcg / ml) | 412434 | 521418 | |||
| E-test Polymyxin | 533408 | 533400 | |||
| E-test Rifampicin | 412450 | 526018 | 526010 | ||
| E-test Spectinomycin | 529218 | 529210 | |||
| E-test Streptomycin | 412454 | 526808 | 526800 | ||
| E-test Sulfamethoxazole | 534118 | 534110 | |||
| E-test Teicoplanin | 412461 | 522018 | |||
| E-test Tetracyklin | 412471 | 522518 | |||
| E-test Taigecyklin | 412475 | 533518 | |||
| E-test Ticarcillin / klavulansyra | 522618 | 522610 | |||
| E-test Tobramycin (hög koncentration) | 533108 | 533100 | |||
| E-test Tobramycin (låg koncentration) | 522718 | 522710 | |||
| E-test Trimethoprim | 523618 | 523610 | |||
| E-test Trimetoprim / sulfametoxazol (1/16) | 412481 | 524418 | |||
| E-test Fosfomycin | 529108 | 529100 | |||
| E-test Fusidinsyra | 511518 | 511510 | |||
| E-test Quinupristin / dalfopristin | 528718 | 528710 | |||
| E-test Kloramfenikol | 412309 | 507518 | 507510 | ||
| E-test Cefaclor | 504518 | 504510 | |||
| E-test Cefalotin | 412307 | 503518 | 503510 | ||
| E-test Cefepime | 412273 | 505018 | 505010 | ||
| E-testa Cefixime | 412275 | 529918 | 529910 | ||
| E-testa Cefoxitin | 412285 | 506518 | 506510 | ||
| E-test Cefoperazone / sulbactam (2/1) | 529318 | 529310 | |||
| E-test Cefotaxime (hög koncentration) | 412279 | 505518 | |||
| E-test Cefotaxime (låg koncentration) | 412281 | 505618 | |||
| E-testa Cefotetan | 506308 | 506300 | |||
| E-test med Cefpirome | 506408 | 506400 | |||
| E-testa Cefpodoxime | 505818 | 505810 | |||
| E-testa Ceftazidime | 412293 | 506718 | |||
| E-testa Ceftaroline | 412291 | ||||
| E-testa Ceftizoxime | 527308 | 527300 | |||
| E-testa Ceftobiprol | 412297 | ||||
| E-test Ceftriaxon (hög koncentration) | 412301 | 506618 | 506700 | ||
| E-test Ceftriaxon (låg koncentration) | 412303 | 507018 | 507000 | ||
| E-testa Cefuroxime | 506918 | 506910 | |||
| E-test Ciprofloxacin | 412311 | 508618 | |||
| E-test Enrofloxacin | 528908 | 528900 | |||
| E-test Erytromycin | 412334 | 510518 | |||
| E-test Ertapenem | 412332 | 531618 | 531610 | ||
| Siffra efter katalog |
|||
| Enskild paket |
Snittförpackning av plast (förvaring t ° -20 ° С) |
||
| namn | 30 remsor | 100 remsor | 30 remsor |
| Bestämning av multimedicinresistens | |||
| E-test Cefotaxime / Cefotaxime + clavulansyra (4 μg / ml) |
412336** | 532208 | 532200 |
| E-test Ceftazidime / Ceftazidime + clavulansyra (4 μg / ml) Designad för att bestämma närvaron av utvidgat spektrum beta-laktamas (ESBL) enzymer inhiberade av klavulansyra i gramnegativa bakterier, inklusive Klebsiella spp., Escherichia coli, Proteus mirabilis, andra medlemmar av Enterobacteriaceae-familjen, Pseudomonas aeruginosa |
412340** | 532508 | 532500 |
| E-test Cefepime / Cefepime + klavulansyra (4 μg / ml) Designad för att bestämma närvaron av utvidgat spektrum beta-laktamas (ESBL) enzymer inhiberade av klavulansyra i gramnegativa bakterier, inklusive Klebsiella spp., Escherichia coli, Proteus mirabilis, andra medlemmar av Enterobacteriaceae-familjen, Pseudomonas aeruginosa |
412338** | 534708 | 534700 |
| E-test Imipenem / Imipenem + EDTA Utformat för att bestämma förekomsten av metall-beta-laktamaseenzymer i gramnegativa bakterier, inklusive Pseudomonas spp., Acinetobacter spp. | 534208 | 534200 | |
| E-test Vancomycin / Teicoplanin Designad för att bestämma resistens (eller måttlig resistens) mot glykopeptider av grampositiva bakterier, inklusive Staphylococcus aureus, Enterococcus spp. |
537208 | 537200 | |
| E-test Cefotetan / Cefotetan + claxacillin Designad för att bestämma närvaron av AmpC-beta-laktamaseenzymer i gramnegativa bakterier |
537108 | 537100 | |
I den här delen kommer vi att titta på end-to-end (E2E) -testning: vi kommer att testa hela applikationen som helhet, och vi kommer att göra det från användarens synvinkel, i själva verket automatisera alla hans handlingar.
I vårt fall består applikationen endast av frontend - det finns helt enkelt ingen backend, så E2E -testning kommer att bestå av att öppna applikationen i en riktig webbläsare, utföra en uppsättning beräkningar och kontrollera giltigheten av värdet på skärmen.
Behöver jag kontrollera alla permutationer, som vi gjorde i enhetstester? Nej, detta har redan verifierats! I E2E -tester kontrollerar vi inte prestanda för enskilda enheter, utan för hela systemet på en gång.
Hur många E2E -tester behöver du?
Den första anledningen till att det inte ska finnas många sådana tester är att välskriven integration och enhetstester ska räcka. E2E -tester bör verifiera att alla element är korrekt länkade.
Den andra anledningen är att de är långsamma. Om det finns hundra av dem, som enhetstester och integrationstester, kommer testningen att passera mycket under en lång tid.
Den tredje anledningen är det oförutsägbara beteendet hos E2E -tester. Det finns ett inlägg om detta fenomen på bloggen Google Testing. Inget sådant oregelbundet beteende observeras i enhetstester. De kan passera och falla - och utan synliga förändringar, enbart på grund av I / O. Kan oförutsägbarheten tas bort? Nej, men du kan minimera det.
För att undvika oförutsägbarhet, gör så få E2E -test som möjligt. Skriv ett E2E -test mot tio andra, och bara när de verkligen behövs.
Skriva E2E -test
Låt oss gå vidare till att skriva E2E -test. Vi behöver två saker: en webbläsare och en server för vår front-end-kod.
Låt oss först ta en titt på hur du konfigurerar webbservern.
Konfigurera en webbserver i Mocha
Nod webbserver? Express kommer omedelbart att tänka på, låt oss se koden:
Låt servern före ((klar) => (const app = express () app.use ("/", express.static (path.resolve (__ dirname, "../../dist"))) server = app . lyssna (8080, klart))) efter (() => (server.close ()))
I funktionen före skapar vi en expressapplikation, pekar den på dist -mappen och ställer in den för att lyssna på port 8080. I efterfunktionen dödar vi servern.
Dist -mappen är där vi lagrar våra JS -skript och där vi kopierar våra HTML- och CSS -filer. Du kan se att vi gör detta i npm build -skriptet i package.json:
("name": "frontend -testing", "scripts": ("build": "webpack && cp public / * dist", "test": "mocha" test / ** / test - *. js "&& eslint test lib ", ...),
Detta betyder att för E2E -test måste du först köra npm run build och sedan npm test. Ja, det här är obekvämt. För enhetstester är detta inte nödvändigt, eftersom de körs under nod och inte kräver översättning och montering.
För fullständighetens skull, låt oss ta en titt på webpack.config.js, som beskriver hur Webpack ska samla filer:
Module.exports = (post: "./lib/app.js", output: (filnamn: "bundle.js", sökväg: path.resolve (__ dirname, "dist")), ...)
Dist -mappen används både i användarmiljön och i E2E -tester. Detta är viktigt - du måste köra E2E -tester i miljöer som är så nära "produktion" som möjligt.
Webbläsarinställning i Mocha
Vår applikation är installerad på servern - det återstår bara att starta webbläsaren för den. Vilket bibliotek kommer vi att använda för automatisering? Jag brukar använda den populära selen-webdriver.
Låt oss först se hur vi använder det innan vi börjar med inställningarna:
Const (preparDriver, cleanupDriver) = require ("../ utils / browser-automation") // ... beskriv ("kalkylator-app", funktion () (låt drivrutinen ... innan (async () => (driver = vänta preparDriver ())) efter (() => cleanupDriver (driver)) det ("borde fungera", asynkroniseringsfunktion () (avvakta driver.get ("http: // localhost: 8080") // ... ))))
I funktionen före förbereder vi föraren, och i efterfunktionen rensar vi den. Förberedelsen av drivrutinen startar webbläsaren och rengöringen stänger den. Observera att drivrutinsinställningen är asynkron och vi kan använda asynkronisering / avvakta för att få koden att se snyggare ut.
I testfunktionen öppnar vi adressen http: // localhost: 8080, igen med hjälp av vänta, eftersom driver.get är en asynkron funktion.
Så hur ser preparDriver och cleanupDriver ut?
Const webdriver = require ("selenium-webdriver") const chromeDriver = require ("chromedriver") const path = require ("path") const chromeDriverPathAddition = `: $ (path.dirname (chromeDriver.path))` exports.prepareDriver = async () => (process.on ("beforeExit", () => this.browser && this.browser.quit ()) process.env.PATH + = chromeDriverPathAddition return inväntar ny webdriver.Builder () .disableEnvironmentOverrides () .forBrowser ("chrome") .setLoggingPrefs ((webbläsare: "ALL", driver: "ALL")) .build ()) exports.cleanupDriver = async (driver) => (if (driver) (driver.quit () ) process.env.PATH = process.env.PATH.replace (chromeDriverPathAddition, ""))
Det här är en knepig sak. Och jag måste erkänna något: den här koden skrevs i blod (åh, och den fungerar bara på Unix -system). Den skrevs med Google, Stack Overflow och webbdriverdokumentation och kraftigt modifierad med vetenskaplig maskinskrivning. Men det fungerar!
I teorin kan du bara kopiera och klistra in koden i dina tester utan att förstå den, men låt oss titta på den en sekund.
De två första raderna ansluter webbdrivrutinen - drivrutinen för webbläsaren. Det sätt som Selenium Webdriver fungerar är att ha ett API (i selen-webdriver-modulen som vi importerar i rad 1) som fungerar med alla webbläsare, och det är beroende av webbläsardrivrutiner för att ... hantera olika webbläsare. Drivrutinen jag använde är chromedriver importerad på rad 2.
Chrome -drivrutinen behöver inte en webbläsare på maskinen: den installerar faktiskt sin egen Chrome -körbar när du installerar npm. Tyvärr, av någon anledning kan jag inte räkna ut det, det kan inte hitta det och chromedriver -katalogen måste läggas till PATH (vilket är exakt vad som inte fungerar på Windows). Vi gör detta på rad 9. Vi tar också bort det från PATH i rengöringssteget, på rad 22.
Så vi har konfigurerat webbläsardrivrutinen. Nu är det dags att konfigurera (och returnera) webbdrivrutinen, vilket vi gör på rad 11-15. Och eftersom byggfunktionen är asynkron och återvänder, väntar vi på den med väntan.
Varför gör vi detta i rad 11-15? Orsakerna döljs av erfarenhetsdimman. Kopiera och klistra gärna in - inga garantier ingår, men jag har använt den här koden ett tag utan problem.
Låt oss börja testa
Vi är klara med installationen - det är dags att titta på koden som använder webdriver för att styra webbläsaren och testa vår kod.
Klassificering, allmänna metoder för att genomföra. Spridningsmetoder: pappersskivmetod, E-test.Metoder för att bestämma bakteriers känslighet för antibiotika är indelade i 2 grupper:
1. Spridningsmetoder:
... med antibiotiska skivor
... med hjälp av E-test
2. Metoder för serieutspädning:
... utspädning i ett flytande näringsmedium (buljong)
... agarutspädning
Metoder för att bestämma känsligheten utvecklades under andra hälften av 60 -talet - början av 70 -talet av XX -talet och har sedan dess inte, från metodologisk synvinkel, genomgått grundläggande förändringar.
Följande steg är gemensamma för alla metoder:
- beredning och kvalitetskontroll av kulturmedier
- beredning av en suspension av de studerade mikroorganismerna (inokulum)
- ympning
- för diffusionsmetoder - steget att placera skivor eller remsor av E -testet på ett fast näringsmedium.
- inkubation
- redovisning och tolkning av resultat
- formulering av rekommendationer för behandling
Diffusionsmetoder är baserade på diffusion av ett antibakteriellt läkemedel (ABP) från bäraren till ett tätt näringsmedium ympat med en mikroorganism och registrerar diametern för hämningszonen (fördröjning) av tillväxten av mikroorganismen som studeras.
... Metoden är mindre känslig och mindre exakt än den utspädda metoden, men i praktiken används den oftare på grund av dess enkelhet. Postat på ref.rf.
... Diffusionshastigheten till agar för alla läkemedel beror på dess struktur, molekylvikt, förekomst av föroreningar, sammansättning och pH hos mediet.
Antibiotisk pappersskivmetod (skivdiffusionsmetod).
... För att utföra denna metod, använd standardskivor som innehåller en viss mängd antibiotika och ett vanligt näringsmedium som är nödvändigt för tillväxt av denna typ av mikroorganismer. Inom vissa gränser är diametern för tillväxtinhiberingszonen omvänt proportionell mot MIC. ... En bakteriesuspension med en viss densitet appliceras på ytan av agar i en petriskål. ... Placera skivor som innehåller en viss mängd antibiotika. ... Inkuberas under gynnsamma förhållanden för varje specifik mikroorganism. ... Diametrarna för tillväxtinhiberingszoner runt skivan mäts i millimeter (med hänsyn till skivans diameter). ... Utvärdera resultatet enligt en särskild tabell genom att jämföra diametern för tillväxtinhiberingszonerna för den testade kulturen med gränsvärdena för zonnens diameter i tabellen. ... Den undersökta kulturen tillhör en av tre kategorier: känslig, måttligt känslig och resistent. 
E-test (E-test eller epsylometrisk metod)
Metoden ligger nära tekniken till metoden för att ställa in pappersskivor.
... En smal polymerremsa (0,5x6,0 cm) används som bärare, på vilken en gradient av ABP -koncentrationer appliceras (från minimum till maximalt). ABP -koncentrationsvärdena i varje sektion av remsan ritas på den yttre (mot forskaren) ytan.
... Hämning av tillväxten av mikroorganismen runt bärarremsan sker i området där koncentrationen av antibiotikumet som diffunderar från bäraren är högre än MIC.
... Vid skärningspunkten mellan den elliptiska tillväxtinhiberingszonen och E-testremsan erhålls MIC-värdet.
E-testet kombinerar enkelheten i pappersskivmetoden och precisionen i den seriella utspädningsmetoden 
Metoder som används för in vitro -jämförande utvärdering av antimikrobiella terapiläkemedel: metoden för serieutspädningar i flytande och fasta odlingsmedier.
Seriella utspädningsmetoder:
... Gör det möjligt att kvantifiera känsligheten hos den isolerade mikroorganismen för antibakteriella medel och bestämma läkemedlets MIC.
... Används för jämförande bedömning av den in vitro antimikrobiella aktiviteten hos det utvecklade generiska läkemedlet och det ursprungliga läkemedlet.
... För att bestämma MIC införs de givna koncentrationerna av antibiotika i ett näringsmedium, som sedan ympas med en kultur av den undersökta mikroorganismen. Efter inkubation bedöms närvaron eller frånvaron av synlig tillväxt.
... Baserat på användning av tvåfaldiga serieutspädningar av ABP-koncentrationer från max till minimum (till exempel från 128 μg / ml, 64 μg / ml, etc. till 0,5 μg / ml, 0,25 μg / ml och 0,125 μg / ml) .
... Utföres i flytande och agarodlingsmedier. Seriell utspädningsmetod i flytande näringsmedium (buljong)
Det finns 2 varianter av denna metod:
makrometod (provrör) och mikrometod (tablett).
Makrometod.
... Testning utförs i rör i en slutvolym på 1 ml för varje spädning.
... Häll 0,5 ml näringsbuljong i varje rör. Antalet rör bestäms av det erforderliga ABP -utspädningsområdet.
... Beredning av en suspension av de studerade mikroorganismerna:
- En arbetssuspension (~ 106 CFU / ml) framställs från en standardsuspension av varje undersökt mikroorganism (~ 108 CFU / ml). Beredning av tvåfaldiga serieutspädningar av ABP: - bered en grundlösning av ABP för det studerade generiska läkemedlet och referensläkemedlet (original) vid en koncentration av 1000 μg / ml och högre (med hänsyn tagen till innehållet i den aktiva substansen) . - från de grundläggande lösningarna för ABP för det undersökta generiska läkemedlet och referensläkemedlet (original) framställs arbetslösningar av ABP med hjälp av ett flytande näringsmedium. (Koncentrationen av arbetslösningar beräknas baserat på den maximala koncentrationen som krävs i serien av utspädningar, med hänsyn tagen till utspädningsfaktorn under efterföljande ympning med en suspension av mikroorganismen) - serieutspädningar bereds: 0,5 ml ABP -arbetslösning införs i det första röret innehållande 0,5 ml buljong. Vispa. Med hjälp av en ny pipett (spets), överför 0,5 ml ABP -lösning i buljong till ett andra rör innehållande 0,5 ml buljong, tills hela den utspädningsserie som har förberetts. Ta bort 0,5 ml från det sista röret. Således erhålls ett antal provrör med ABP -lösningar, vars koncentrationer skiljer sig i angränsande provrör med en faktor 2. Ympning: 0,5 ml mikrobiell suspension med mikroorganismkoncentration ~ 106 införs i varje rör med 0,5 ml av motsvarande ABP -utspädning. Den slutliga koncentrationen av mikroorganismen i varje rör är ~ 5x105 CFU / ml. ... Kontroll - ett provrör med buljong och odling av mikroorganismen (tillväxtkontroll). Negativ kontroll - ett rör med buljong (sterilitetskontroll). ... Inkubation: Alla rör, förseglade med proppar eller lock, inkuberas under förhållanden som gör att mikroorganismernas tillväxt kan testas. ... Redovisning och tolkning av resultat: provrör med kulturer ses i överfört ljus. Odlingen av odlingen i ABP -röret jämförs med kontrollröret. - närvaron av mikroorganismstillväxt i buljongen (buljonggrumlighet) indikerar att denna koncentration av antibiotikumet är otillräcklig för att undertrycka dess livskraft. - när koncentrationen av antibiotikumet ökar, försämras tillväxten av mikroorganismen. Den första lägsta koncentrationen av antibiotika (från en serie serieutspädningar), där bakterietillväxt inte är visuellt bestämd, anses vara den minsta hämmande koncentrationen (MIC). läkemedel mot antibiotikabehandling - jämför resultaten som erhållits för originalläkemedlet och det undersökta generiska läkemedlet. En slutsats görs om deras likvärdighet med avseende på spektrumet (lista över använda mikroorganismer) och graden av antimikrobiell aktivitet (MIC -värden).  ... Bestämning av MBC: från de sista rören med tillväxthämning, inokulera med en slinga på sektorerna i petriskålen. För MBC, som i regel är flera utspädningar mindre än MIC, tas koncentrationen av läkemedlet i det sista provröret, från vilket ympningen inte gav tillväxt. ... Nackdelen med metoden: låg produktivitet - applikationen är begränsad till studier av ett litet antal mikroorganismer.
... Bestämning av MBC: från de sista rören med tillväxthämning, inokulera med en slinga på sektorerna i petriskålen. För MBC, som i regel är flera utspädningar mindre än MIC, tas koncentrationen av läkemedlet i det sista provröret, från vilket ympningen inte gav tillväxt. ... Nackdelen med metoden: låg produktivitet - applikationen är begränsad till studier av ett litet antal mikroorganismer.
Mikrometod
Testförfarandet är detsamma som för makrometoden.
.Slutvolymen är upp till 0,2 ml. Närvaron av lämplig laboratorieutrustning: en platta för 96 brunnar med sterila lock, flerkanaliga pipetter. Arbetslösningar av ABP kan läggas till plattans brunnar i förväg och sedan förvaras förseglade i polyeten vid temperaturer under 60 ° C fram till användning. ... Fördelar med metoden: - hög produktivitet - möjlighet till långtidslagring av förberedda tabletter - besparing av förbrukningsvaror. Postat på ref.rf
Seriell utspädningsmetod i agarmedium. Testprincipen liknar buljongspädningsmetoden. Beredning av en suspension av de undersökta mikroorganismerna: - en standardsuspension av varje undersökt mikroorganism bör innehålla ~ 108 CFU / ml. - standardmikrobiell suspension för experimentet späds ~ 10 gånger tills koncentrationen av mikroorganismen är ~ 107 CFU / ml. Beredning av tvåfaldiga serieutspädningar av ABP för det ursprungliga läkemedlet och det läkemedelsgeneriska läkemedlet för undersökning utförs på samma sätt som för metoden för utspädning av buljong. Agarmediet smälts och kyls till en temperatur av 45-50 ° C. ... Beredning av plattor med agarmedium och ABP -spädningar: blanda agarmediet och ABP -lösningarna direkt i en petriskål (för plastfat med en diameter på 90 mm, tillsätt 18 ml smält och kyld agar till 2 ml ABP -lösning). ... Ympning och inkubation: 1-2 | il av suspensionen av de studerade mikroorganismerna överförs till ytan av agarmediet med en bakteriologisk slinga. Sålunda är den sista inokulationsdosen ~ 104 CFU (en standardbakteriologisk slinga med en diameter på 3 mm bär 1-2 | il vätska). ... En fläck med en diameter på 5-8 mm bildas på agarns yta. Efter torkning vänds skålarna upp och inkuberas under förhållanden som är gynnsamma för tillväxten av de studerade mikroorganismerna. ... Redovisning och tolkning av resultat: liknande metoden för utspädning av buljong. Petriskålar placeras på en mörk, icke-reflekterande yta. BMD anses vara ABP -koncentrationen som orsakade fullständig hämning av synlig tillväxt. ... Kontroll: ympas med en suspension av kulturer av mikroorganismer agarplattor utan ABP (tillväxtkontroll). Negativ kontroll: agarplattor (sterilitetskontroll). Fördelar med metoden: känsligheten hos flera mikroorganismer kan bestämmas på en platta.
Studievolymen på jämförande in vitro -bedömning av antimikrobiell aktivitet för generiska och ursprungliga antimikrobiella behandlingar.
Studiens omfattning av jämförande in vitro -bedömning av den antimikrobiella aktiviteten hos generiska antimikrobiella läkemedel:
Studiens syfte: bekräftelse av att det generiska läkemedlet överensstämmer med referensen (original) i spektret (mikroorganismer) och graden (MIC, MBC) av antimikrobiell aktivitet.
. Uppsättning testade mikroorganismer: 1-2 stammar av var och en av mikroorganismerna som ingår i verkningsspektrumet
- referensinsamlingsstammar
- kliniska stammar isolerade på sjukhus
.Värdena för IPC och MBC bestäms
.Kontroll: referensläkemedel - originalläkemedel
Förväntat resultat: MIC och MBC för de utvecklade generiska antimikrobiella läkemedlen ligger inom acceptabla intervall och sammanfaller helt med MIC och MBC för jämförelsemedicin (originalläkemedel) i relation till insamling och kliniska stammar.
Studiernas ordning för att bestämma in vitro antimikrobiell aktivitet för nya antimikrobiella föreningar:
. Primär bedömning av känsligheten för nya föreningar av referensstammar av olika typer av gramnegativa och grampositiva mikroorganismer (4-5 stammar för varje art).
.Detaljerad studie av graden av antibakteriell aktivitet av föreningar mot stammar av gramnegativa och grampositiva mikroorganismer från internationella samlingar med kända resistensmekanismer (serieutspädningsmetod).
.Studie av aktivitet mot kliniska stammar av opportunistiska och patogena mikroorganismer i jämförelse med kända läkemedel av en liknande kemisk grupp eller liknande i antimikrobiell effekt:
-vid övervägande aktivitet mot grampositiva mikroorganismer är kontrollen naturliga penicilliner, cefalosporiner från I-II-generationer, makrolider, linkosamider; - med aktivitet mot gramnegativa mikroorganismer är kontrollen polymyxin B, aztreonam; - för läkemedel med ett brett spektrum av åtgärder är kontrollen semisyntetiska penicilliner, aminoglykosider, tetracykliner, cefalosporiner av III - IV -generationer
... Utvärdering av antimikrobiell aktivitet mot problematiska patogener: meticillinresistenta stafylokocker, bensylpenicillinresistenta Streptococcus pneumoni, multiresistenta enterobakterier, aminoglykosidresistenta bakterier av släktet Pseudomonas, etc.
.De initiala terapeutiska koncentrationerna av nya läkemedel fastställs med hänsyn till den toxicitet som bestämts i experiment vid studier av akut toxicitet.
... Den jämförande graden av antibakteriell aktivitet av läkemedel bedöms med värdet av MIC eller MBC, bestämt åtminstone vid 2 värden av inokuleringsdosen: minimum - 10 4 - 10 5 CFU / ml och maximalt - 10 6 - 10 9 CFU / ml, beroende på typen av patogen; Hittills finns det inga metoder som skulle göra det möjligt att med absolut säkerhet förutsäga den kliniska effekten av antibiotika vid behandling av infektionssjukdomar. Uppgifterna om resultaten för att bestämma känsligheten kan dock fungera som en bra riktlinje för läkare vid val och korrigering av antibiotikabehandling.
Bokens innehållsförteckning öppnas nära
1. Farmaceutisk mikrobiologi. Ämnet och målen för farmaceutisk mikrobiologi.
2. Apotek och läkemedel: ursprung och utveckling.
3. Läkemedel: definition, klassificering.
4. Läkemedels sammansättning | läkemedelssubstans, hjälpämne.
5. Original- och generiska läkemedel. Läkemedlets namn.
10. Skadliga faktorers verkan på mikroorganismer. Temperaturfaktorns påverkan och dess användning i läkemedel.
11. Strålningens effekt på mikroorganismer, strålningstyper.
12. Påverkan av kemiska skadliga faktorer på mikroorganismer
13. Sterilisering. Sterility Assurance Level (SAL). Kriterier för att välja en steriliseringsmetod.
14. Termisk och kemisk sterilisering
15. Övervakning av effektiviteten hos steriliseringsanordningar.
16. Industriell desinfektion
17. Desinfektionsmedel och antiseptika. Krav på kemiska desinfektionsmedel och antiseptika.
18. Konserveringsmedel och deras användning vid läkemedelsproduktion